Одне з найбільш часто зустрічаються в клінічній практиці кардіологів та педіатрів патологічних станів серця — дефект міжшлуночкової перегородки. Це деструктивне розлад діагностується, як правило, у дітей у віці до 3-х років і з анатомо-фізіологічної сторони характеризується формуванням на стадії розвитку плода сполучення між правим і лівим шлуночком серця, що призводить до гострих гемодинамічних порушень. Зареєстрована частота прояву подібних аномалій становить близько 17-42% в якості самостійного ізольованого захворювання. Однак такий дефект нерідко спостерігається у складі інших кардіологічних патологій.
У медичній літературі цей ВПС (вроджена вада серця) був детально описаний ще в 1874 році співробітником кафедри фізіологічної Імператорського інституту експериментальної медицини В. Ф. Толочиновым.
Дефект міжшлуночкової перегородки у дітей проявляється відставанням фізичного розвитку, миготливою аритмією, задишкою, швидкою стомлюваністю.
Часто ДМЖП структурно входить в групу з 4-х складних вад, так звану тетраду Фалло, до якої також зараховуються деструктивна патологія венозного стовбура, транспозиція магістральних-транспортних судин, атрезія легеневої артерії з дефектом міжшлуночкової перегородки та тристулкового клапана.
Зміст
- Класифікація та форми ДМЖП
- Причини виникнення дефективної патології міжшлуночкової перегородки
- Гемодинамічні відхилення при ДМЖП
- Методи інструментальної діагностики
- Лікарська терапія
- Хірургічна корекція
Класифікація та форми ДМЖП
Класифікаційні ознаки різних дефектів межжелудочной перегородки базуються на оцінці абсолютної величини аномального просвіту і зіставленні його розмірів з діаметром венозного отвору. Так, патологія Толочінова-Роже характеризується наявністю деструктивного освіти 1-3 мм. Симптоматично подібна деструкція може тривалий час не проявляти себе як у дитячому віці, так і у дорослих. Набагато небезпечніше патологія, складова 1/2 артеріального стовбура або перевищує його діаметр. На підставі анатомічної локалізації, якою характеризується спостерігається дефект міжшлуночкової перегородки серця, виділяють:
Найчисленнішими і часто зустрічається анатомо-фізіологічними патологіями даної категорії є група перимембранозных дефектів міжшлуночкової перегородки, які складають 75% від загального числа всі реєструються вад серця. Локалізація аномального просвіту і його діаметр мають найважливіше значення для функціональних параметрів провідних тканин атріовентрикулярного пучка Гіса, що забезпечують передачу нервових сигналів від передсердь до шлуночків. В результаті ДМЖП будь-якого типу виникає купірування імпульсів різного характеру і ступеня тяжкості.
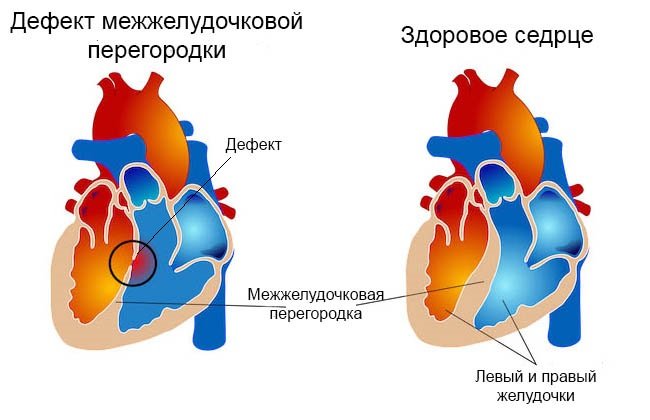
Причини виникнення дефективної патології міжшлуночкової перегородки
Найбільш часто такі патологічні розлади з’являються внаслідок порушень внутрішньоутробного розвитку, обумовлених різними факторами. Дефект міжшлуночкової перегородки у плода формується протягом I триместру вагітності, коли відбувається закладка всіх життєво важливих органів. Порушення нормального протікання даного процесу і призводить до досить важких наслідків. У деяких випадках ДМЖП, який є надзвичайно небезпечним анатомо-фізіологічним розладом, поєднується з іншими патологіями внесердечной локалізації, наприклад із синдромом Дауна, всілякими дисфункціями нирок та ін.
До безпосередніх факторів, що провокує патології ембріогенезу і, як наслідок, утворення дефекту міжшлуночкової перегородки у новонародженого, зараховуються різноманітні негативні впливи на організм матері у перші 8 тижнів вагітності. Насамперед, мова йде про такі проблеми:
- вірусних ураженнях;
- діяльності хвороботворної бактеріальної мікрофлори;
- епідемічному паротиті;
- патології ендокринної системи;
- алкогольної і лікарської інтоксикації;
- іонізуюче радіаційному опроміненні;
- гострій нестачі вітамінів і мікроелементів в раціоні майбутньої матері.
Потовщення міжшлуночкової перегородки та інші форми ДМЖП можуть спостерігатися у новонародженого і при патологічному протіканні вагітності. До цієї групи провокуючих чинників відносять ранні і сильно виражені токсикози, високий ризик мимовільного переривання вагітності (викидня), прийом у цьому період гормональних препаратів та інші. Є відомості і про причини генетичної етіології виникнення цього деструктивного анатомо-фізіологічного розлади. Мутації такого роду в рідкісних випадках можуть поєднуватися з різними аномаліями розвитку опорно-рухового апарату і кінцівок.
Гемодинамічні відхилення при ДМЖП
Внутрисердечные гемодинамічні розлади починають виявлятися приблизно через 3-5 діб після народження. Діагностика в ранньому неонатальному періоді істотно ускладнена особливостями розвитку новонародженого. Зокрема, сторонні шуми в серці відсутні з причини пропорційного кров’яного тиску в обох шлуночкових відділах. Цей ефект носить назву неонатальної гіпертензії легенів. Поступово тиск у кровоносній системі змінюється в бік зниження, внаслідок чого створюється необхідний для проведення діагностичних процедур градієнт. Кров починає циркулювати зліва направо — із зони підвищеного тиску в область зниженого.
Обсяг скидання цілком визначається анатомічними характеристиками аномального освіти і його діаметром. Нагнітання кров’яний рідини під тиском крізь патологічний канал викликає гіпертрофію стінок шлуночкової порожнини, а потім і розширення магістральної артерії, що зв’язує серце з легенями. Стрімке зростання тиску, особливо при великому діаметрі аномального отвори, призводить до рефлекторного спазмування легеневої тканини. Постійний кров’яний скидання збідненої киснем фізіологічної рідини провокує стан гіпоксії у всіх життєво важливих органах і м’язових тканинах. В результаті спостерігається стан гіпоксії — кисневого голодування.
Крім того, порушення нормального внутрішньосерцевого кровотоку в комплексі з виникаючою на цьому тлі миготливою аритмією створює умови для утворення тромбів і перенесення емболів в судинну сітку мозку. Фіброз міжшлуночкової перегородки, при якому практично відсутня компресійна опір ліво-правому скиду крові, називається нерестриктивным і вважається одним з найбільш важких ускладнень, що викликаються даною патологією. При великому діаметрі аномального каналу обидві порожнини починають функціонувати як єдина насосна камера, що може призвести до гострої лівошлуночкової недостатності.
Методи інструментальної діагностики
Кожна дитина в неонатальний період проходить обов’язковий огляд лікарем-кардіологом, які мають спеціальну підготовку для своєчасного виявлення внутрішньоутробних патологій та аномалій розвитку.
Найменші симптоми, виявлені при аускультації (прослуховування) серця, служать серйозним приводом до призначення додаткової діагностики інструментальними засобами.
Це дозволить уникнути серйозних ускладнень у майбутньому. В даний час діагностика будь-якої патології або дисфункції серцевого механізму здійснюється комплексно з застосуванням рентгенологічної та ультразвукової апаратури, електро-, ангіокардіографії, двомірної допплерехокардіографіі, а також різних допоміжних методів.
Вони допоможуть в разі необхідності сформувати цілісну та об’єктивну клінічну картину, прояснити приховані нюанси перебігу патологічного процесу, правильно і адекватно вибрати оптимальну терапевтичну тактику. ЕКГ дозволяє швидко виявити аномалії систолічного тиску в шлуночкових порожнинах і правому передсерді, визначити характер і ступінь тяжкості аритмії, зміни нервової провідності та блокування пучка Гіса. Сучасні високочутливі методи фонокардиографии здатні зафіксувати навіть самий легкий серцевий шум. Вкрай важливою діагностичною процедурою є і УЗД.
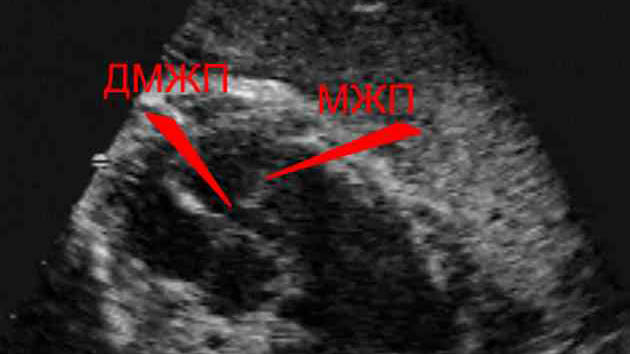
Таке обстеження дає можливість спеціалісту візуально оцінити ступінь і характер патологічного процесу, зміни в швидкості циркуляції крові, перевірити функціональний стан клапанного апарату. На фронтальній рентгенограмі органів грудної клітини при значних розмірах аномального отвори помітна кардіомегалія — деструктивне збільшення серцевих камер і легеневої магістральної артерії. З допомогою допплерехокардіографіі визначається точна локалізація та анатомічні параметри дефектного шунта, напрямок скидання через нього, ознаки регургітації трикуспідального характеру. При різному розташуванні патологічного каналу оптимальна візуалізація досягається в різних проекціях, що подібна апаратура, обладнана поворотними датчиками, що дозволяє зробити.
Лікарська терапія
Безсимптомний перебіг ДМЖП при невеликому діаметрі аномального отвори дозволяє утриматися від оперативного втручання. Такий діагноз передбачає динамічний моніторинг стану немовляти. У деяких випадках не виключено мимовільне закриття дефектного шунта в період між 1-4 роками, рідше в більш пізньому віці. В інших ситуаціях здійснюється консервативна терапія серцевої недостатності або хірургічна корекція. Конкретна клінічна тактика розробляється з урахуванням діаметра патологічного каналу, його локалізації, віку пацієнта, розвитку компенсаторного механізму. При відсутності безпосередньої небезпеки для життя зазвичай питання про терміновому оперативному втручанні не ставиться.
Як правило, дефекти міжшлуночкової перегородки мінімального діаметра не викликають у дітей серйозного дискомфорту. У цьому випадку лікарями даються необхідні рекомендації по режиму.
Методи консервативного лікування включають в себе прийом лікарських засобів інотропної підтримки, до яких відносяться симпатоміметичні препарати, серцеві глікозиди та ін. При підвищеній легеневої гіпертензії застосовуються різні інгібіторні з’єднання ангіотензинперетворюючого ферменту. Необхідно знати, що препаратів, здатних закрити дефективний шунт, не існує. Вся лікарська терапія носить виключно профілактичний і підтримуючий характер.
Хірургічна корекція
Оптимальна тактика лікування завжди вибирається на підставі гемодинамічних характеристик дефекту міжшлуночкової перегородки і базується на відомих для подібних випадків прогнозах. Залежно від цього клінічна методика може бути радикальної або паліативної. Перша передбачає застосування різних способів хірургічної корекції, які найчастіше полягають в ушиванні дефектного каналу малого діаметра П-образними швами або пластику спеціальної синтетичної латкою, виготовленої з тефлонового або дакронового матеріалу. Сьогодні такі операції проводяться все рідше. Сучасні медичні технології дозволяють використовувати для закриття патологічного отвори спеціально для цієї мети створену біологічну тканину, наприклад консервований ксеноперикард.
Також часто виконується рентгенэндоваскулярная оклюзія, що представляє собою транскатетерную хірургічну малоінвазивну методику, суть якої полягає у закритті аномального каналу за допомогою спеціальної рентгенографічної апаратури різної конструкції і технічних можливостей. Зараз у великих кардіологічних центрах використовується пристрій Амплатцера, що характеризується високою ефективністю при порівняно невеликому діаметрі дефекту міжшлуночкової перегородки. Процедура катетеризації проводиться під загальною анестезією і передбачає введення в шлуночок серця через стегнову артерію тонкого зонда, який имплантирует біологічну тканину, що повністю закриває патологічний отвір.